Indinavir (Crixivan®)
Einleitung
Indinavir (IDV, MK-639, Handelsname Crixivan®, Hersteller; Merck Sharp and Dome) gehört zur Klasse der antiretroviralen Substanzen die Protease-Inhibitoren genannt werden. Weitere Medikamente dieser Klasse sind Amprenavir, Atazanavir, Darunavir, Lopinavir, Nelfinavir, Ritonavir, Saquinavir und Tipranavir. Die Wirkungsweise dieser Substanzen besteht in der Hemmung eines viruseigenen Enzyms, der HIV-Protease. Die Blockierung dieser "Eiweiss-Schere" führt zu unreifen, nicht-infektiösen Viren, d.h. sie können keine weiteren Zellen mehr infizieren. Protease Inhibitoren verhindern deshalb bei HIV-infinzierten Personen neue Infektionszyklen. Zwischen den einzelnen Proteaseinhibitoren besteht eine weitgehende Kreuzresistenz; d.h. gegen Viren, die auf die eine Substanz unempfindlich geworden sind nützen auch die anderen Medikamente dieser Substanzklasse nichts mehr, oder zumindest nicht mehr zuverlässig.
In der Schweiz ist Indinavir zugelassen zur Kombinationstherapie der HIV-Infektion des Erwachsenen wenn eine Behandlung angezeigt ist.
Protease Inhibitoren werden vorzugsweise zusammen mit zwei Nukleosidanaloga RT-Hemmern eingesetzt. Im Idealfall handelt es sich um drei neue Substanzen, mit denen eine Person noch nie zuvor behandelt wurde. Bei vorbehandelten Personen ist dies nicht immer möglich. In diesem Fall sollte ein Therapiewechsel mindestens zwei neue Substanzen ohne Kreuzresistenz umfassen mit denen die Person noch nie zuvor behandelt wurde. Die Zugabe lediglich einer neuen Substanz zu einer unbefriedigenden Therapie führt zur Entwickung von Resistenzen und ist zum Scheitern verurteilt.
Resultate von Studien
In der Studie ACTG 3201 wurden 1156 AZT-vorbehandelte Menschen mit weniger als 200 CD4-Zellen (durchschnittliche CD4-Zellzahl 78/ul) zusätzlich entweder mit 3TC oder mit 3TC + Indinavir behandelt. Nach im Mittel 9.5 Behandlungsmonaten war in der mit AZT + 3TC + Indinavir behandelten Gruppe bei 6% und in der lediglich mit AZT + 3TC behandelten Gruppe bei 11% ein Fortschreiten der Krankheit zu beobachten und 3.1 bzw. 1.4% der Menschen waren verstorben. Dies entspricht einer Risikoreduktion um gut 50 Prozent.
In der in Brasilien durchgeführten Studie 028 wurden 996 bisher unbehandelte Menschen mit 50-250 CD4-Zellen (mittlere CD4-Zellzahl 146/ul) und im Mittel 30'000 HIV-RNA-Kopien/ml Plasma entweder mit AZT alleine, AZT + Indinavir oder mit Indinavir alleine behandelt. Nach ca. einem Jahr erhielten alle Patienten zusätzlich 3TC. Die vorläufige Analyse nach durchschnittlich 58 Behandlungswochen zeigt, dass sowohl die Indinavir-Monotherapie (bzw. Indinavir +3TC) als auch Indinavir + AZT (bzw. Indinavir+AZT+3TC) klinisch wirksamer als eine AZT-Monotherapie (bzw. AZT+3TC) ist; das Risiko einer Krankheitsprogression (Auftreten von AIDS-definierenden Erkrankung oder Tod) wurde um 61 bzw. 70% reduziert; 34, 42 und 9% der Patienten hatten im Blut einen nicht nachweisbaren viral load; die untere Nachweisgrenze des verwendeten Tests betrug 500 RNA-Kopien/ml.
In der offenen Studie DMP-266 -0062 wurden die Kombinationen Efavirenz + AZT + 3TC, Indinavir + AZT + 3TC und IDV + EFZ bei 450 asymptomatischen PatientInnen ohne vorgängige Behandlung mit 3TC, einem NNRTI oder einem Proteaseinhibitor miteinander verglichen. Nach 72 Wochen zeigte die intent-to-treat Analyse bei Patienten unter EFZ + AZT + 3TC häufiger einen viral load von weniger als 50 RNA-Kopien/ml als die beiden anderen Behandlungsarme (60% unter EFV + AZT + 3TC versus 40% unter IDV + AZT + 3TC).
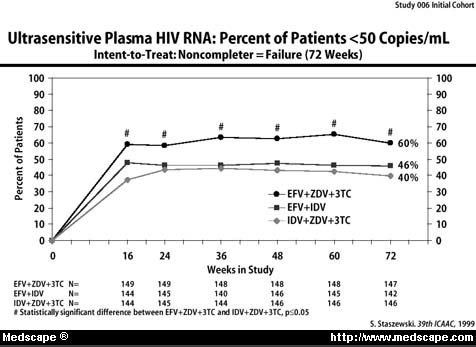
Eine Subanalyse bei Patienten mit einem initialen viral load von > 100'000 RNA-Kopien zeigte ein ähnliches Bild (Daten zum Zeitpunkt 24 Wochen, Nachweisgrenze des Tests 400 RNA-Kopien/ml).
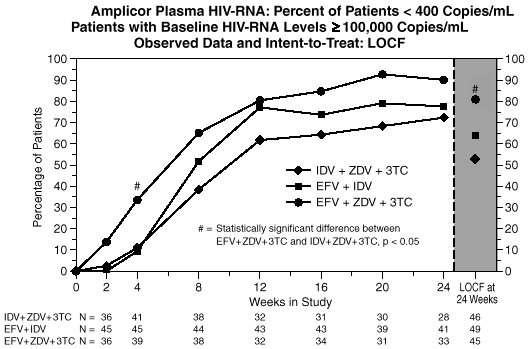
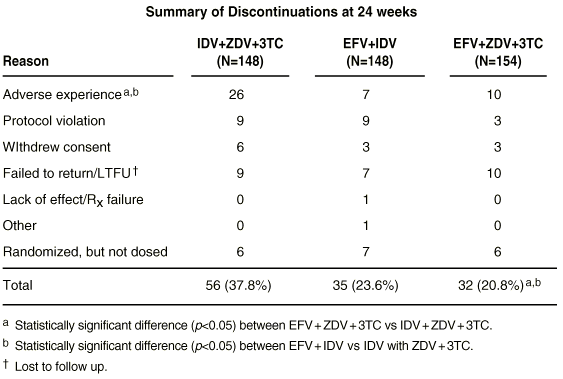
Zum Abbruch der Behandlung führende Nebenwirkungen waren unter der Kombination IDV + AZT + 3TC ebenfalls häufiger als unter EFV + AZT + 3TC. ZNS-Nebenwirkungen waren häufiger in den EFV enthaltenden Behandlungsarmen, führten jedoch selten zum Behandlungsabbruch (Daten zum Zeitpunkt 24 Wochen).
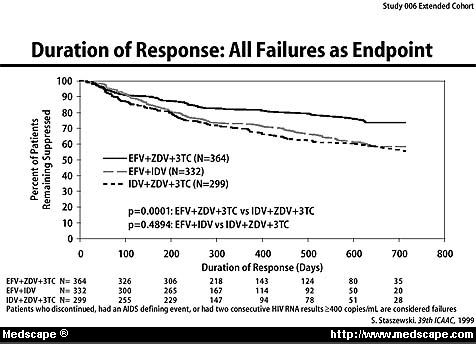
Die Zeit bis zum Therapieversagen [= Therapieabbruch, AIDS-definierende Erkrankung oder 2 viral load Werte >400 RNA-Kopien/ml] von zusätzlich eingeschlossenen 1266 PatientInnen (expanded cohort), davon 80% ohne Vorbehandlung, mit im Mittel 340 CD4-Zellen/ul und einem viral load 4.8 log (ca. 70'000 RNA-Kopien/ml) unter den drei Behandlungsregimes zeigt nachfolgende Kaplan-Meier Graphik.
Resistenz
Eine Resistenzentwicklung gegen Indinavir erfolgt schrittweise durch die Anhäufung mehrerer Mutationen. Die bedeutendsten erfolgen an den Positionen 10, 46, 63 und 84; weitere Mutationen werden an den Positionen 20, 24, 54, 64, 71, 84 und 90 beobachtet. Ritonavir und Indinavir sind zu 100% kreuzresistent.
Nebenwirkungen
Die häufigsten beobachteten Nebenwirkungen sind Übelkeit, Bauchschmerzen, Durchfall, Kopfschmerzen und Nierensteine. Das Risiko für Koliken der ableitenden Harnwege lässt sich durch die Einhame von zusätzlich 1.5 l Flüssigkeit pro Tag beträchtlich vermindern. Selten ist das Auftreten einer interstitiellen Nephritis mit medullären Verkalkungen und kortikaler Atrophie bei PatientInnen mit einer Leukozyturie.
Interaktionen
Indinavir, die anderen
Proteaseinhibitoren
und die Nicht-Nukleosidanloga RT-Hemmer werden in der Leber über
das
Cytochrom P450-System abgebaut. Wechselwirkungen mit anderen
Medikamenten
und Substanzen, sogenannte Interaktionen, sind vor allem dann zu
erwarten,
wenn diese dasselbe Enzymsystem benutzen. Das Resultat dieser
Wechselwirkungen
sind häufig zu hohe oder zu niedrige Blutspiegel von Indinavir
und/oder
der anderen eingenommenen Substanz. Zu hohe Blutspiegel führen
unter
Umständen zu Nebenwirkungen, zu tiefe Blutspiegel zum Verlust der
Wirksamkeit.
Indinavir sollte nicht
zusammen
mit folgenden Substanzen eingenommen werden: Astemizol, Cisapride,
Midazolam,
Rifampicin, Terfenadin, Triazolam.
Eine Übersicht
- gegliedert nach
therapeutischen Gruppen - über die wichtigsten Substanzen deren
gleichzeitige
Einnahme mit Indinavir zu bedeutsamen Wechselwirkungen führt
findet
sich in der Tabelle Interaktionen
mit antiretroviralen Medikamenten.
Lagerungsvorschriften
Indinavir ist erhältlich als Kapseln à 200 und 400mg und sollte bei Zimmertemperatur (unter 30 Grad Celsius) und vor Feuchtigkeit geschützt (in der Originalflasche) aufbewahrt werden.
Dosierung
Indinavir wird üblicherweise "geboosted" mit Ritonavir [und zusammen mit Nukleosidanaloga RT-Hemmern] eingenommen. Die Dosierung bei zuvor unbehandelten PatientInnen beträgt unabhängig von der Nahrungsaufnahme 2 x 100/800 mg pro Tag (2 x 1 Kapsel Ritonavir à 100mg + 2 x 2 Kapseln Indinavir à 400mg).
Die registrierte
Dosierung lautet: Einnahme von 3 x 800 mg pro Tag (2 Kapseln à
400 mg alle 8 Stunden) nüchtern (eine Stunde vor oder zwei Stunden
nach einer Mahlzeit). Die Einnahme von Indinavir zusammen mit
Kaffee/Tee, Toast & Marmelade (ohne Butter oder Margarine) oder mit
Cornflakes beeinträchtigt die Aufnahme von Indinavir nicht oder
nur
wenig. Wird Indinavir hingegen zusammen mit einer schweren Mahlzeit
eingenommen
gelangt lediglich ein Bruchteil der eingenommen Substanz ins Blut! Eine
zweimaltägliche , nahrungsunabhängige Einnahme wird erst
durch die gleichzeitige Einnahme einer kleinen Dosis Ritonavir
möglich!
Wird Indinavir zusammen mit Nicht-nukleosidanalogen
RT-Hemmern oder anderen Protease-Inhibitoren eingenommen, ist infolge
möglicher Wechselwirkungen
mit diesen Substanzen unter Umständen eine andere
Dosierung
angezeigt.
Ein durch Indinavir
verursachtes Nierensteinleiden
lässt sich häufig durch die Einnahme grösserer
Flüssigkeitsmengen
zusammen mit Entzündungs- und Schmerz hemmenden sowie Krampf
lösenden
Medikamenten behandeln ohne dass die Behandlung unterbrochen werden
muss.
Kommt es hingegen bei erreichtem Behandlunsgziel zu wiederholten
Koliken,
wird eine die Umstellung auf ein anderes Präparat empfohlen.
Kommentar
Aus der Studie ACTG 320 liessen sich drei Konklusionen ableiten:
Die Studie 028 zeigte, dass eine Indinavir-Monotherapie klinisch wirksamer als eine AZT-Monotherapie ist und dass eine Behandlung mit Indinavir + AZT nicht signifikant wirksamer ist als eine Indinavir-Monotherapie. Konklusionen: Die Kombination von einem Protease- und einem RT-Inhibitor und mehr noch die Monotherapie mit einem Protease Inhibitor ist klinisch ungenügend wirksam und vermögen bei der Mehrzahl der Patienten nicht, um den viral load auf nicht mehr nachweisbare Werte zu senken..Die Therapie mit zwei Nukleosidanaloga RT-Hemmern ist nicht mehr der Standart; (zumindest nicht bei Patienten mit CD4-Zellen <200/ul). Die Resultate von Studien mit anderen Protease-Inhibitoren werden bestätigt: Der Einsatz Proteaseinhibitor- haltiger Kombinationen bei AZT-vorbehandelten Patienten mit fortgeschrittener Krankheit führt zu einem raschen klinischen Nutzen. Die Zugabe zweier Medikamente ist besser als die Zugabe lediglich einer Substanz bzw. die Zugabe lediglich einer neuen Substanz zu einer (un)befriedigenden Therapie (eine "sequentielle Monotherapie" ) führt zur Entwickung von Resistenzen und ist zum Scheitern verurteilt.
Die Studie 006 schliesslich zeigte, dass die Kombination AZT + 3TC + EFV der Kombination AZT + 3TC + ungeboostetes Indinavir überlegen ist.
Die Kombination einer kleinen Dosis Ritonavir blockiert den Abbau von Indinavir im Darmepithel und in der Leber. Dadurch können - ähnlich wie bei den Kombination [Ritonavir/Fos-Amprenavir, Ritonavir/Atazanavir, Ritonavir/Lopinavir und Ritonavir/Saquinavir] hohe Wirkstoffkonzentrationen der "geboosteten" Substanz erreicht werden.
Mit Ritonavir geboostetes Indinavir führt bei zweimal täglicher, nahrungsunabhängiger Einnahme zu bedeutend wirksameren Wirkstoffspiegeln. Allerdings kommt es auch häufiger zu Nierensteinen. Wichtig ist deshalb eine ausreichende Flüssigkeitszufuhr. Gemäss den akutellen DHHS Guidelines gehört Ritonavir/Indinavir nicht zu den bevorzugten Komponenten eines Regimes für einen Therapiebeginn.
Literatur
Last update 10.06.2007Arzneimittel-Kompendium der Schweiz: Fachinformation Hammer SM, Squires KE, Hughes MD, et al. A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less. AIDS Clinical Trials Group 320 Study Team. N Engl J Med. 1997 Sep 11; 337(11): 725-733. Staszewski S, Morales-Ramirez J, Godofsky EW, et al. Longer time-to-failure and durability of response with efavirenz + ZDV + 3TC: first analysis of full 1266 patient cohort from study 006. (39th ICAAC, September 26-29, 1999, San Francisco, Abstract 507.
